Нагреть и уничтожить
Исследователи изучали два вида наночастиц с различным материалом ядра и золотой оболочкой. Наиболее успешными в качестве термосенсибилизаторов в лазерной противоопухолевой терапии, по мнению ученых, оказались наночастицы, ядро которых состоит из легированного алюминием или галлием оксида цинка, сообщает портал Naked Science. Основные выводы опубликованы в Journal of Quantitative Spectroscopy and Radiative Transfer.

«Думаю, что применение новых типов наночастиц, описанных в нашей статье, значительно повысит эффективность противоопухолевой терапии, — рассказал “Стимулу” руководитель рабочей группы, профессор базовой кафедры фотоники и лазерных технологий Института инженерной физики и радиоэлектроники СФУ Сергей Карпов. — Насколько мне известно, в одной из клиник Германии сейчас проводятся клинические испытания этого метода лазерной гипертермии с использованием золотых наночастиц».
Метод нагрева — самый прогрессивный
В настоящее время метод локальной и избирательной гипертермии — нагрева опухолевых клеток при помощи различных устройств и технологий, в результате которого повреждаются только злокачественные клетки без вреда для здоровых тканей, — считается одним из наиболее перспективных и активно развивающихся. Надежды медицинского сообщества на универсальные возможности радио- и химиотерапии не оправдались, у этих видов лечения онкологических заболеваний обнаружился целый ряд серьезных противопоказаний и побочных эффектов.
Как сообщает сайт https://oncogermany.de/, локальная гипертермия применяется при лечении большинства поверхностных и глубоко расположенных солидных новообразований, в том числе на поздних стадиях онкопроцесса, неоперабельных или имеющих ограниченные показания для резекции опухолей, при наличии метастазов, а также в тех случаях, когда все остальные методы терапии солидных новообразований не принесли должного результата. Противопоказания к локальной гипертермии, по сути, отсутствуют. Не назначают ее носителям стимулятора ритма сердца ввиду риска возникновения помех в его работе. У лиц с нарушенными тепловыми ощущениями и большими металлическими имплантатами могут развиться побочные реакции в связи с нежелательным перегревом.
![]() Суть метода состоит в достижении высокой температуры (42–47 °С) вблизи опухолевых клеток, при которой наблюдается их избирательная гибель (злокачественные клетки в силу особенностей их строения более чувствительны к высоким температурам, чем здоровые)
Суть метода состоит в достижении высокой температуры (42–47 °С) вблизи опухолевых клеток, при которой наблюдается их избирательная гибель (злокачественные клетки в силу особенностей их строения более чувствительны к высоким температурам, чем здоровые)
По данным немецких специалистов, локальная гипертермия уже хорошо зарекомендовала себя в лечении опухолей головного мозга, головы и области шеи, первичного и метастатического рака печени и легких, новообразований пищеварительного канала, поджелудочной железы, мочевого пузыря, простаты, молочной железы, рака кожи, метастазов в лимфоузлах, лимфом и др.
Для этого метода используются различные физиотерапевтические средства (высокоинтенсивный ультразвук, лазерное излучение, переменные магнитные поля и так далее). В целом суть метода состоит в достижении высокой температуры (42–47 °С) вблизи опухолевых клеток, при которой наблюдается их избирательная гибель (злокачественные клетки в силу особенностей их строения более чувствительны к высоким температурам, чем здоровые). Локальная гипертермия в настоящее время чаще используется для повышения эффективности комбинированной или комплексной терапии больных, однако в некоторых ситуациях может выступать и в качестве монотерапии.
Наводчики для теплового удара
Гипертермия как метод активно развивается последние десять-пятнадцать лет. Так называемая интерстициальная (внутритканевая) лазерная термотерапия ИЛТТ (Laser Induced Interstitial Thermotherapy — LITT) — это разновидность данного метода, и у нее есть свои преимущества.
![]() Опухоль нагревают до 45 °С, в результате ее клетки практически необратимо повреждаются из-за изменения структуры белка — грубо говоря, оказываются «сваренными»
Опухоль нагревают до 45 °С, в результате ее клетки практически необратимо повреждаются из-за изменения структуры белка — грубо говоря, оказываются «сваренными»
«Во-первых, при использовании лазерной термотерапии можно непрерывно следить за процессами прогревания в режиме реального времени и визуализировать температурные изменения в тканях. Во-вторых, нагрев происходит в строго заданном объеме и в соответствии с конфигурацией опухоли. Для ИЛТТ используют инфракрасный лазер: опухоль нагревают до 45 градусов Цельсия, в результате ее клетки практически необратимо повреждаются из-за изменения структуры белка — грубо говоря, оказываются “сваренными”. Лазер воздействует прямо через кожу пациента или лапароскопически, это значит, что хирургические вмешательства сводятся к минимуму», — рассказал аспирант Института инженерной физики и радиоэлектроники СФУ Артем Костюков.
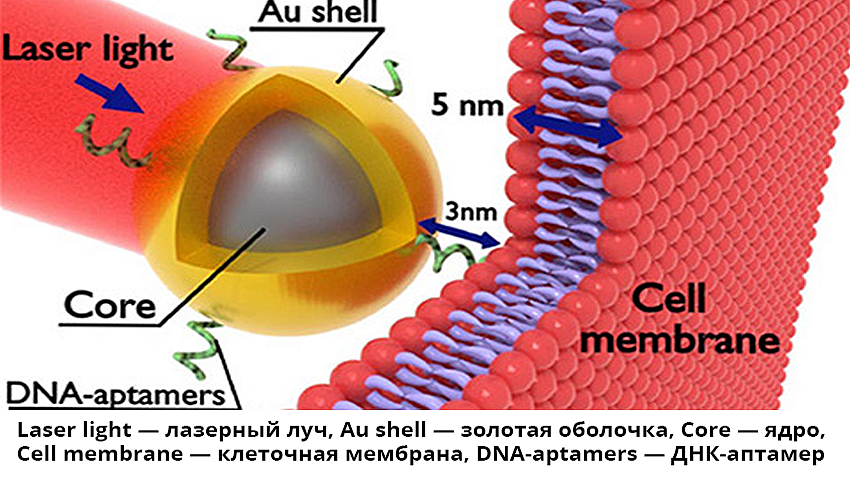
А чтобы сделать процесс нагрева направленным и щадящим здоровые ткани организма, нужно использовать термосенсибилизаторы: магнитные или плазмонно-резонансные наночастицы, которые вводят в кровоток или непосредственно в опухоль.
Ученые объясняют, что эти частицы строго избирательно закрепляются на мембранах лишь злокачественных клеток благодаря наличию на поверхности золотой оболочки распознающего агента — ДНК-аптамеров. Находясь на мембране и поглощая лазерное излучение, наночастицы будут выделять тепловую энергию, повреждающую мембрану и приводящую к гибели клетки. Это позволяет снизить мощность лазерного излучения по сравнению с его прямым воздействием на опухоль. Помимо этого существует важная возможность изменять «настройки» частиц, выбирая для их конструирования различные материалы, подбирая размеры, форму и структуру.
Идея помещать наночастицы золота в человека для решения терапевтических задач не нова. К примеру, их можно нагружать лекарственными средствами и использовать для адресной доставки медикаментов прямо в опухоль. А можно облучать таких своеобразных «наводчиков», концентрирующихся прямо в переродившихся клетках, лазером — они поглощают оптическое излучение, создают вокруг себя интенсивное тепловое поле с четкими границами и убивают раковые клетки перегревом.
![]() Пик поглощения частицы смещается в длинноволновую область ближе к инфракрасному излучению, и именно в этой области гемоглобин условно «прозрачен» и не получает ненужную нагрузку
Пик поглощения частицы смещается в длинноволновую область ближе к инфракрасному излучению, и именно в этой области гемоглобин условно «прозрачен» и не получает ненужную нагрузку
«Однако цельная золотая наночастица поглощает лазерное излучение на той же длине волны, что и человеческий гемоглобин, — воздействуя лазером на нее, мы можем вмешаться в здоровые ткани и спровоцировать ухудшение общего состояния пациента. Чтобы этого не произошло, наши американские коллеги некоторое время назад предложили делать наночастицы “сборными” — ядро из кварца “одевать” в золото», — рассказывает Сергей Карпов.
Пик поглощения частицы смещается в длинноволновую область ближе к инфракрасному излучению, и именно в этой области гемоглобин условно «прозрачен» и не получает ненужную нагрузку.
«Мы же пошли еще дальше, — продолжает ученый, — предложив усовершенствовать передачу тепловой энергии от наночастицы к раковым клеткам благодаря новым материалам. Расчеты показали, что наночастицы, ядро которых состоит из легированного алюминием (или галлием) оксида цинка, исключительно быстро поглощают и отдают тепло по сравнению с привычными кварцевыми “собратьями”».

Исследователи также отметили, что им удалось изменить понимание, как следует проверять наночастицы-термосенсибилизаторы на «профпригодность». «Оказалось, что не по оптическим cвойствам нужно оптимизировать наночастицы, а скорее по тепловым. Золотая “обертка” проверена годами: золото прекрасно совместимо с человеческим организмом и гипоаллергенно. А проверка ядра, в сущности, сводится к вопросу, насколько быстро оно способно поймать и передать тепловую энергию», — констатировал постдок Института оптики Рочестерского университета Илья Рассказов.
В состав научного коллектива также вошли ученые Института физики имени Л. В. Киренского СО РАН, Института вычислительного моделирования СО РАН, Сибирского государственного университета науки и технологий имени М. Ф. Решетнёва и Рочестерского университета (США).
Темы: Наука и технологии

