«Наша задача — спасти нейроны от гибели»

Инсульт головного мозга — второй по количеству жертв «убийца» людей в мире. Среди причин смертности впереди только инфаркт миокарда. В России ежегодно регистрируется порядка 400 тысяч случаев инсульта, и 35% из них с летальным исходом. Смертность от этой болезни у нас в четыре раза выше, чем в США и Европе. Причем речь идет о людях всех возрастов, а не только о пожилых, как принято считать. Намного больше инсульту подвержены жители мегаполисов. Лидеры печальной статистики — Москва и Санкт-Петербург.
Наиболее тяжелый вид инсульта — геморрагический. В результате травмы или нарушения прочности стенок рвутся сосуды и происходит кровоизлияние в мозг.
Но наиболее часто регистрируется ишемический инсульт. В этом случае нейроны погибают из-за нарушения кровообращения, а также из-за того, что к тканям мозга перестают поступать кислород и питательные вещества. Доля ишемического инсульта — порядка 80% от общего числа случаев, и часто он становится причиной инвалидности. Лишь каждый восьмой пациент, перенесший ишемический инсульт, восстанавливает свое здоровье в полном объеме. Остальные же случаи заканчиваются или смертью, или инвалидностью.
![]() Гибель нейронов сопровождается реакциями, аналогичными тем, что происходят в клетках иммунной системы при воспалении. В результате начинают гибнуть живые нейроны — развивается лавинообразный процесс, затрагивающий обширные зоны мозга
Гибель нейронов сопровождается реакциями, аналогичными тем, что происходят в клетках иммунной системы при воспалении. В результате начинают гибнуть живые нейроны — развивается лавинообразный процесс, затрагивающий обширные зоны мозга
Процесс гибели клеток мозга называется нейродегенерацией. При различных заболеваниях — эпилепсии, ишемии, болезни Альцгеймера — нейроны гибнут практически одинаково, включаются очень похожие механизмы. Фундаментальными разработками, направленными на повышение жизнеспособности клеток, занимаются очень многие лаборатории в мире.
Наш собеседник — профессор, доктор биологических наук Валерий Зинченко. Он возглавляет лабораторию внутриклеточной сигнализации Института биофизики клетки РАН в подмосковном наукограде Пущино. Одна из тем, над которыми работает его команда, напрямую связана со спасением гибнущих нейронов.
Этот проект — международный, он выполняется в рамках Федеральной целевой программы «Исследования и разработки по приоритетным направлениям развития научно-технологического комплекса России на 2014-2020 годы» (Программа ERA.Net RUS PLUS Министерства образования и науки Российской Федерации, Проект 14.616.21.0039).
Совместно с российскими учеными исследования проводят коллеги из Университетского медицинского центра Гамбург–Эппендорф и Университета Вюрцбурга (Германия), а также Лёвенского католического университета (Бельгия).
— Валерий Петрович, какие фундаментальные исследования привели вас к изучению способов защиты нейронов?
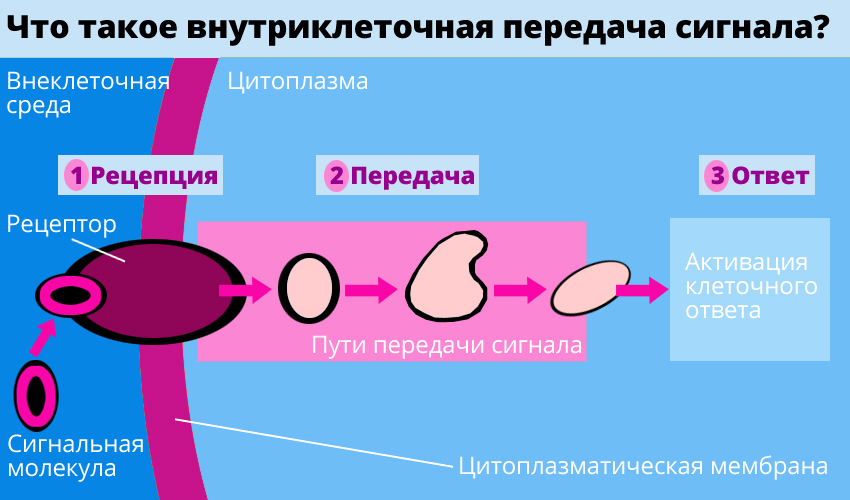
— Наша лаборатория традиционно занимается изучением механизмов внутриклеточной сигнализации. Дело в том, что клетка с внешней стороны мембраны воспринимает широкий спектр химических сигналов. Это могут быть и низкомолекулярные биологически активные соединения, и довольно крупные и сложные по своей структуре биомакромолекулы. Для восприятия этих сигналов на поверхности клетки есть целая мозаика воспринимающих молекул — рецепторов. При связывании с рецептором определенной молекулы (лиганда) в клетке запускается каскад сигнальных процессов, активируются те или иные биохимические реакции. Многие заболевания как раз и происходят из-за нарушения внутриклеточных сигнальных путей, когда какая-то реакция не идет или идет не с той скоростью. Многие из таких путей уже достаточно хорошо исследованы, и связь их с некоторыми болезнями очевидна.
— А какие исследования проводятся у вас в лаборатории?
— Ранее мы исследовали механизмы передачи сигнала как в электровозбудимых клетках, например нейронах, так и в невозбудимых, в частности в жировых клетках. Нам удалось получить интересные результаты по механизмам развития диабета второго типа.
Одновременно мы продолжали исследовать внутриклеточные процессы в культивируемых нервных клетках, разработали для этого способы визуального наблюдения за состоянием нейронов в режиме реального времени. Это и позволило нам подключиться к решению проблемы защиты нейронов от гибели при ишемии.
— Термин «ишемия» широко используется, однако не все точно знают, что это такое. Поясните, пожалуйста.
— Ишемия — это состояние, в котором могут оказаться разные системы организма и разные органы, не только мозг. Допустим, происходит закупорка сосудов, и тогда прекращается доступ к нейронам или другим клеткам не только кислорода (это называется гипоксией), но еще и питательных веществ, дающих клетке энергию. Известно, что клетки могут существовать и без кислорода, используя гликолиз. Но при ишемии прекращается доступ и кислорода, и энергетических субстратов. Продолжительная ишемия неизбежно ведет к гибели или к необратимым повреждениям клеток.
![]() При ишемии прекращается доступ в клетку и кислорода, и энергетических субстратов. Продолжительная ишемия неизбежно ведет к гибели или к необратимым повреждениям клеток
При ишемии прекращается доступ в клетку и кислорода, и энергетических субстратов. Продолжительная ишемия неизбежно ведет к гибели или к необратимым повреждениям клеток
Оказалось, что гибель нейронов сопровождается реакциями, аналогичными тем, что происходят в клетках иммунной системы при воспалении. А в результате этих реакций начинают гибнуть живые нейроны, развивается лавинообразный процесс, затрагивающий обширные зоны мозга. В итоге гибнет больше нейронов, чем в самом начале ишемии. Учитывая, что этот процесс более длительный, чем начальная стадия, есть возможность, применяя фармакологию, вмешаться в развитие событий и спасти значительную часть клеток.
— Каков вклад вашей лаборатории в решении этой проблемы?
— На развитие последствий инсульта, губительных для нейронов, могут оказывать влияние сигнальные молекулы белковой природы. Наш приоритет заключается в том, что мы нашли вещество, которое может защитить нейроны от гибели при инсульте, — это белок интерлейкин, представитель целого семейства родственных белков. Нам удалось распутать сложную цепь событий в клетке, которые обусловливают защитный эффект интерлейкина. Схематически это изображено на рисунке.
Нейроны на внешней поверхности мембраны имеют молекулы — рецепторы интерлейкинов. Рецептор построен весьма сложно, и от него, от той части молекулы, которая обращена внутрь клетки, идет несколько сигнальных путей, которые в конечном итоге влияют на активность определенных генов, выполняющих защитные функции.
Однако белки или не вообще проникают в мозг через гематоэнцефалический барьер, или плохо проникают. Отсюда возникают две сопутствующие задачи: либо нужно найти эндогенный, то есть внутренний способ активации производства этих белковых молекул, либо заменить их более простыми соединениями, которые делают то же самое, имитируя действие интерлейкина на внутриклеточном уровне.
— По какому пути пошли вы?
— Мы нашли замену интерлейкинам. Можно относительно простыми низкомолекулярными веществами заставить работать необходимые сигнальные пути. Наш препарат довольно сложен по составу. Он состоит из пяти простых соединений и уже хорошо работает на культурах клеток, но мы сейчас пытаемся сделать его более эффективным. Для этого надо еще глубже понимать фундаментальные механизмы действия таких соединений. Есть возможности, которые мы еще не задействовали, позволяющие сделать протекторный эффект, предотвращающий гибель клеток, более длительным. В тот препарат, над которым мы работаем, входят как вещества экстренного действия, так и те, которые ингибируют более отдаленные негативные процессы, связанные с воспалительными реакциями. Один из вариантов композиции из взаимодополняющих веществ сейчас находится на стадии патентования. Некоторые фундаментальные аспекты этой проблемы, связанные с характером внутриклеточных процессов, все еще не ясны.
— Как возникла коллаборация с зарубежными учеными?
— Международный исследовательский коллектив предложили создать наши немецкие коллеги, которые занимались разработками, направленными на повышение жизнеспособности клеток. Они прочитали наши публикации в международных журналах и предложили нам участвовать в проекте.
— Какие эксперименты вы проводите в рамках проекта?
— Проект объединил несколько групп исследователей, которые изучают проблемы гибели нейронов на разном уровне. Наши немецкие коллеги больше сконцентрированы на физиологических экспериментах. Это значит, что они работают на целых животных. Снимают электрические характеристики мозга, делают локальную ишемию и смотрят, как меняется электрическая активность мозга. Дают определенные протекторы, как ранее исследованные, так и новые. Протектор — это вещество, которое спасает нейроны от гибели.
![]() Мы нашли замену интерлейкинам. Можно относительно простыми низкомолекулярными веществами заставить работать необходимые сигнальные пути
Мы нашли замену интерлейкинам. Можно относительно простыми низкомолекулярными веществами заставить работать необходимые сигнальные пути
Второй уровень — это молекулярная биология, когда используются микроантитела, воздействующие на тромбы и приводящие к их рассасыванию. Вообще, закупорка сосудов — очень большая проблема, инсульт часто сопровождается тромбообразованием. Создание антител, способных проникать в мозг для борьбы с тромбами, — очень перспективное направление. Иммунопрепараты на основе маленьких антител хорошо себя зарекомендовали. Однако их производство и очистка представляют собой сложную биотехнологическую задачу, такие препараты очень дороги, и пока маловероятно, что они станут доступными.
Но вернемся к нашему проекту. Его третья составляющая — работа на изолированных клетках, выделенных из мозга животных. На уровне культур или срезов мозга. Этим занимаемся мы. Почему? Потому, что такие клеточные и тканевые модели ишемии очень дешевы по сравнению даже с лабораторными животными. При этом мы можем в режиме реального времени с помощью специальных флуоресцентных маркеров наблюдать, что происходит с клеткой, с ее внутренней средой и энергетическим состоянием. Хотя мы тоже проверяем в конце концов эффект наших соединений на животных, вводя исследуемые вещества в мозг через артерию.
— Вы исследуете механизмы реакций нейронов на гипоксию и фармакологические соединения на культуре клеток животных. Думаете ли вы при этом о побочных эффектах для человека, если дело дойдет до лекарственных препаратов?
— Исследование механизмов действия потенциальных новых лекарственных соединений должно проводиться на молекулярном, клеточном уровне, в экспериментах на животных и при апробировании в клинике. Только при таком сочетании исследователей разной специализации можно выявить как новые неожиданные полезные терапевтические эффекты, так и побочные негативные последствия применения препаратов. Тут нужно тесное сотрудничество академических ученых и медиков-практиков, предоставление медикам возможности самим проводить эксперименты на животных и заниматься научной работой.
![]() Иммунопрепараты на основе маленьких антител хорошо себя зарекомендовали. Однако их производство и очистка представляют собой сложную биотехнологическую задачу, такие препараты очень дороги и пока маловероятно, что они станут доступными
Иммунопрепараты на основе маленьких антител хорошо себя зарекомендовали. Однако их производство и очистка представляют собой сложную биотехнологическую задачу, такие препараты очень дороги и пока маловероятно, что они станут доступными
В крупных европейских исследовательских центрах сосуществуют как лечебные подразделения, так и лаборатории для доклинических испытаний на животных. Такая система организации работы существенно ускоряет путь от исследования биологического действия нового лекарства до его применения в клинике и позволяет более надежно выявить возможные побочные действия. Конечно, вероятность того, что исследуемые нами препараты будут вступать в реакции с другими компонентами клетки, образовывать комплексы с ними, не исключена. Только тщательное исследование позволит ответить на этот вопрос. Мы надеемся, что именно селективность тех веществ, действие которых мы изучаем, обеспечит минимальные побочные эффекты.
— Какие еще научные проблемы решаются в вашей лаборатории? Ваши исследования могут помочь в лечении других тяжелых болезней, к примеру эпилепсии?
— Поскольку, как уже говорилось, в основе гибели нервных клеток при разных патологиях зачастую лежат общие механизмы, сходные с воспалительными реакциями, способы фармакотерапии могут быть распространены и на другие нейродегенеративные процессы и состояния, сопровождающиеся гиперактивацией нейронов. Нас, безусловно, интересуют экспериментальные модели разных заболеваний. Речь идет о тех из них, при которых могут быть нарушены сигнальные пути, обнаруженные нами при исследовании гибели нейронов при ишемии, — об эпилепсии, болезни Паркинсона, болезни Альцгеймера.
Темы: Наука и технологии